Il latte di bufala e il metaboloma del fluido ruminale sono significativamente influenzati dal foraggio verde
Negli ultimi anni la maggior consapevolezza acquisita dai consumatori ha spinto il settore zootecnico ad impegnarsi nella creazione di allevamenti più sostenibili, in grado di garantire il benessere degli animali e la produzione di alimenti funzionali e di alta qualità. Un alimento può essere definito funzionale se ricco in molecole bioattive. Queste ultime, come la carnitina, la δ-valerobetaina e la acetil-carnitina intervengono in differenti meccanismi per la prevenzione ed il trattamento di numerose patologie, pertanto, risultano benefiche per la salute dell’uomo. Alcuni autori, per indagare la presenza e l’incremento di tali metaboliti funzionali nei prodotti di origine animali, hanno effettuato diversi studi sulla relazione tra somministrazione di foraggi verdi e aumento di molecole bioattive nel latte attraverso un approccio metabolomico (Rocchetti et al., 2020). La metabolomica è lo studio sistematico del profilo chimico di un sistema biologico, basato sull’identificazione di molecole a basso peso molecolare prodotte durante un determinato metabolismo. Il metaboloma è inoltre strettamente correlato al genotipo di un organismo, alla sua fisiologia e all’ambiente nel quale vive. Per tale motivo, questa disciplina offre l’opportunità di studiare le relazioni genotipo-fenotipo e genotipo-ambiente. Il presente studio si propone di utilizzare un approccio metabolomico per valutare l’influenza di diverse strategie di alimentazione sulla concentrazione di metaboliti nel latte e nel liquido ruminale di bufale in lattazione.
La sperimentazione è stata condotta in un allevamento di bufale situato nel Sud Italia e ha coinvolto 32 soggetti. Gli animali sono stati casualmente suddivisi in due gruppi omogenei in base ai giorni medi di lattazione, all’ordine di parto e alla produzione di latte. La durata totale della sperimentazione è stata di 90 giorni, dal 1° giugno al 31 Agosto, con 3 tempi di campionamento (Giugno, Luglio ed Agosto). Gli animali sono stati alimentati con diete isoproteiche ed isoenergetiche somministrate due volte al giorno. Il gruppo di controllo (Dry Group; DD) è stato alimentato con una dieta standard a base di foraggi e concentrati, differentemente, il gruppo sperimentale (Zero Grazing; ZG) ha ricevuto una razione simile al gruppo DD ma con un’inclusione del 30% di sorgo fresco. La tecnica del “zero grazing” o “cut and carry” rappresenta una valida alternativa al pascolo in quanto la raccolta e l’immediata somministrazione dei foraggi verdi, evita il verificarsi di fenomeni negativi, quali il sovrappascolo, erosione del suolo o perdita di biodiversità. Questa tecnica, inoltre, permette sia di ridurre i costi di alimentazione, sia di introdurre foraggio verde di alta qualità nella dieta degli animali che, come è noto, rappresenta una preziosa fonte di minerali, vitamine e precursori di alcune molecole funzionali come la Trimetillisina (TML). La composizione e le caratteristiche chimiche dei componenti somministrati nel gruppo di controllo (DD) e nel gruppo sperimentale (ZG) sono riportate in Tabella 1.
Tabella 1. Razione mista totale (kg), composizione chimica (% di sostanza secca, DM) e unità foraggere latte (MFU) delle diete somministrate a bufale del gruppo zero grazing (ZG) e controllo (DD). DM: sostanza secca; CP: proteina grezza; EE: estratto etereo; CF: fibra grezza; NDF: fibra neutro detersa; ADF: fibra acido detersa; NSC: carboidrati non strutturali; MFU: unità foraggere latte.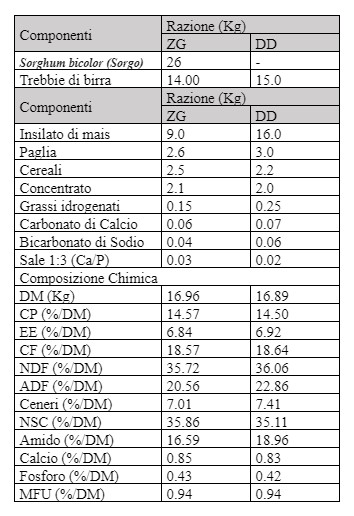
Le analisi per il rilevamento dei metaboliti sono state effettuate utilizzando la cromatografia liquida ad alte prestazioni (HPLC) 1260 Infnity Series (Agilent Technologies) dotato di un sistema Diode Array Detector (Agilent Technologies) e accoppiato a uno spettrometro di massa (MS; Agilent Technologies) con una sorgente Dual ESI (Agilent Technologies). Tra le molecole individuate, sono state riportate solo quelle con un errore di massa inferiore a 10 ppm.
L’analisi dei dati, viste le caratteristiche comuni delle molecole funzionali rilevate, è stata effettuata tramite un’analisi multivariata chiamata Principal Component Analysis (PCA), che consiste nell’individuare due macrocomponenti così da diminuire le variabili (Figura 1).
Figura 1. Grafici PCA dei dati LC-MS acquisiti per i tre campionamenti di latte da bufale del gruppo DD alimentate con dieta standard (TMR) (quadrati rossi) e il gruppo ZG alimentate con TMR + 30% di foraggio verde (triangoli blu). (A) Campionamento di giugno; PC1 rappresenta il 50,85% e PC2 il 21,45% della varianza totale; (B) Campionamento di luglio; varianza di PC1 63,64% e varianza di PC2 12,46%; C) Campionamento di agosto; varianza di PC1 65,66% e varianza di PC2 14,57%.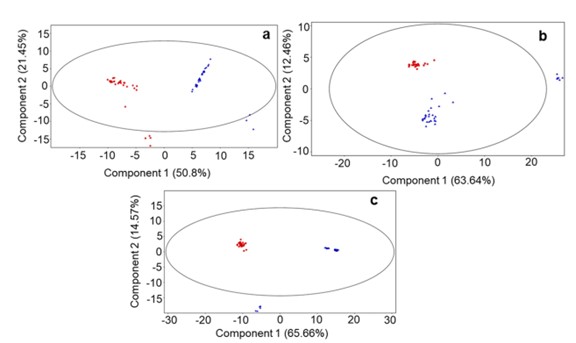
Parallelamente è stata eseguita un’analisi della varianza attraverso il metodo ANOVA. Inoltre, durante lo studio, sono stati valutati due importanti parametri: l’assunzione di sostanza secca (DMI) e il Body Condition Score (BCS). Quest’ultimo è stato misurato ogni 15 giorni utilizzando una scala da 1 a 9 (Wagner et al., 1988), mentre il DMI è stato determinato utilizzando la seguente equazione:
DMI = (91 g ∗ Peso Metabolico) + (0.27 kg ∗ kg ECM)
Entrambi i parametri sono risultati simili nel gruppo che aveva ricevuto un’integrazione di foraggio fresco (ZG) e nel gruppo al quale è stata somministrata la dieta standard (DD). Allo stesso modo, non sono state rilevate differenze significative sugli aspetti quantitativi e qualitativi della produzione di latte.
Dall’analisi del profilo metabolomico sono emerse rilevanti differenze tra i campioni di latte prelevati. Per ogni periodo di campionamento, ovvero giugno, luglio e agosto, sono stati trovati rispettivamente 118, 127 e 215 metaboliti statisticamente differenti, e come emerge dalla seguente tabella (Tabella 2), 10 tra questi metaboliti sono stati identificati.
Tabella 2. Metaboliti ottenuti dall’analisi LC-MS, accumulati in modo differenziato nei campioni di latte di bufale del gruppo DD (alimentati con razione standard (TMR) e del gruppo ZG (alimentati con TMR + 30% di foraggio verde) analizzati per 3 mesi (giugno, luglio e agosto). Le identificazioni sono state eseguite confrontando i risultati con composti noti presenti in database elettronici liberamente disponibili. Per l’identificazione sono stati utilizzati il Milk Composition Database (MCDB) e il Bovine Metabolome Database (BMDB). Up, sovra-regolazione; Down, sotto-regolazione; nd, composti non rilevati dopo l’analisi statistica. LnFC, logaritmo naturale della variazione.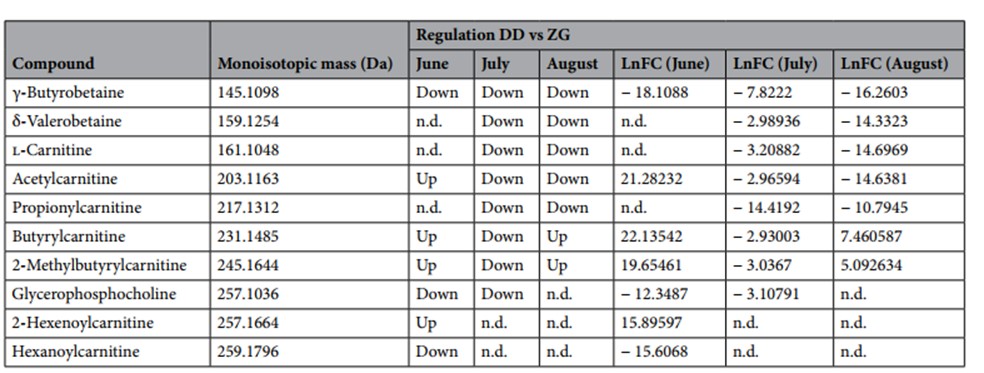
La carnitina, i suoi derivati (acetilcarnitina, propionilcarnitina, butirrilcarnitina, 2-metilbutirrilcarnitina, esanoilcarnitina e 2-esenoilcarnitina) e il precursore (γ-butirrobetaina), nei mesi in cui vengono rilevati, differiscono nei gruppi DD e ZG. In particolare, si osserva una sovra-regolazione di questi composti nel latte degli animali alimentati con l’integrazione di foraggio verde. In particolare, la l-carnitina e la l-acetilcarnitina sono risultate più abbondanti nel latte del gruppo sperimentale nei mesi di Luglio ed Agosto. La L-carnitina non è stata rilevata nel primo campionamento, mentre la L-acetilcarnitina è risultata più abbondante nel gruppo DD. Per quanto riguarda la propionilcarnitina, risulta sempre in diminuzione nei campioni del gruppo di controllo, ad eccezione del mese di giugno nel quale non è stata proprio rilevata. La butirrilcarnitina è sempre maggiore nel gruppo DD, ad eccezione del secondo periodo di campionamento.
La 2-esenoilcarnitina e l’esanoilcarnitina sono risultate presenti solo nel mese di Giugno, ma la prima con una maggiore incidenza nel gruppo DD rispetto a ZG, differentemente dall’esanoilcarnitina maggiormente presente nei campioni di latte del gruppo ZG. Infine, la 2-metilbutirroilcarnitina è risultata più abbondante nel gruppo DD, ad eccezione di quanto accade nel mese di Luglio. La δ-valerobetaina (DVB), è stata rilevata in due momenti del campionamento (Luglio e Agosto) ed è risultata maggiormente presente nei campioni di latte del gruppo ZG. La γ-butirrobetaina (GBB) è stata rilevata in diminuzione nei tre mesi in tutti i campioni appartenenti al gruppo DD. La glicerofosfocolina, nei primi due tempi di campionamento è risultata minore nel gruppo DD, rispetto al gruppo ZG.
Successivamente, da una analisi univariata per ciascun gruppo di alimentazione (DD e ZG), sono stati rilevati rispettivamente 145 e 66 metaboliti diversi. Tale analisi, effettuata in relazione ai tre tempi di campionamento, ha identificato 7 metaboliti per il gruppo DD e 4 per il gruppo ZG. Come si evince dalle seguenti tabelle (Tabella3 e Tabella 4), nel gruppo DD vi è una chiara tendenza rappresentata dalla maggior presenza di metaboliti a Luglio rispetto a Giugno (ad eccezione dell’acetilcarnitina) e da una diminuzione ad Agosto rispetto a Giugno (ad eccezione della glicerofosfocolina). Per quanto riguarda il gruppo ZG, le molecole rilevate risultano più abbondanti nel mese di Luglio rispetto a Giugno, mentre nel confronto Agosto vs Giugno si osserva una maggiore variabilità
Tabella 3. Metaboliti ottenuti tramite analisi LC-MS, accumulati in modo differenziato nei campioni di latte di bufale del gruppo DD (alimentati con dieta standard (TMR) per l’intero periodo sperimentale (giugno, luglio e agosto). Le identificazioni sono state eseguite confrontando i risultati con composti noti presenti in database elettronici liberamente disponibili. Per l’identificazione sono stati utilizzati il Milk Composition Database (MCDB) e il Bovine Metabolome Database (BMDB). Up, sovra-regolazione; Down, sotto-regolazione; nd, composti non rilevati dopo l’analisi statistica. LnFC, logaritmo naturale della variazione.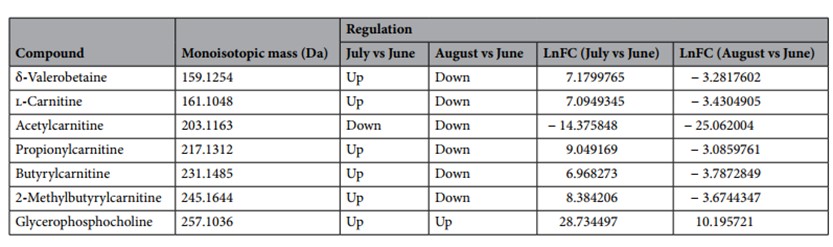
Tabella 4. Metaboliti ottenuti dall’analisi LC-MS accumulati in modo differenziato nei campioni di latte di bufale del gruppo ZG (alimentati con TMR+30% di foraggio verde) per l’intero periodo sperimentale (giugno, luglio e agosto). Le identificazioni sono state eseguite confrontando i risultati con composti noti presenti in database elettronici liberamente disponibili. Per l’identificazione sono stati utilizzati il Milk Composition Database (MCDB) e il Bovine Metabolome Database (BMDB). Up, sovra-regolazione; Down, sotto-regolazione; nd, composti non rilevati dopo l’analisi statistica. LnFC, logaritmo naturale della variazione.
L’analisi del metaboloma del fluido ruminale ha fornito invece un’evidenza sull’efficacia di un’alimentazione caratterizzata dall’inclusione di foraggio verde nell’incrementare i metaboliti bioattivi. L’analisi multivariata è stata effettuata per rilevare il clustering intrinseco tra i campioni di fluido ruminale. Il grafico della PCA riportato in Figura 2 ha rivelato una separazione dei due gruppi (DD in rosso e ZG in blu) nella PC2, che rappresenta il 16,56% della varianza totale.
Figura 2. Principal Component Analysis dei dati LC-MS acquisiti da fluido ruminale ottenuto dal gruppo DD alimentato con una razione standard (TMR) (quadrati rossi) e dal gruppo ZG alimentato con TMR + 30% di foraggio verde (triangoli blu). La PC1 rappresenta il 68,94% e PC2 il 16,56% della varianza totale.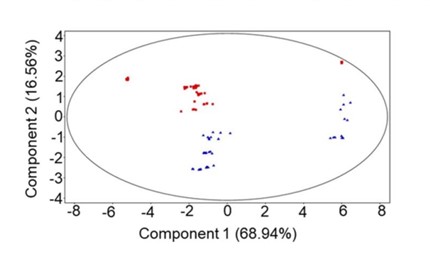
Nel caso specifico sono stati individuati 3-(2-idrossifenil)-propanoato, acido indolo-3-acrilico, oleamide (cis-9,10-ottadecenoamide) e 20-carbossi-leucotriene B4 e, come emerge dalla Tabella 5, risultano essere maggiormente presenti nel gruppo ZG.
Tabella 5. Metaboliti ottenuti dall’analisi LC-MS, accumulati in modo differenziato nei campioni di fluido ruminale di bufale del gruppo DD (alimentati con razione standard (TMR)) e del gruppo ZG (alimentati con TMR + 30% di foraggio verde). Le identificazioni sono state eseguite confrontando i risultati con composti noti presenti in un database elettronico liberamente disponibile. Per l’identificazione è stato utilizzato il Bovine Metabolome Database (BMDB). Up, sovra-regolazione; Down, sotto-regolazione; nd, composti non rilevati dopo l’analisi statistica. LnFC, logaritmo naturale della variazione.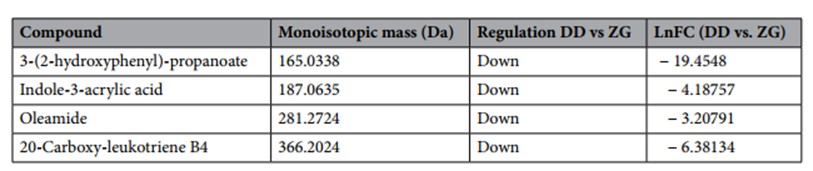
In particolare, 3-(2-idrossifenil) il propanoato, noto anche come acido melilotico o melilotato, è prodotto dal batterio anaerobico Clostridium xylanolyticum dall’acido cinnamico (de Almeida et al., 2018). L’acido indolo-3-acrilico è un prodotto del metabolismo del triptofano che migliora la funzione della barriera epiteliale intestinale e allevia le risposte infiammatorie (Marklova, 1999). Il microbiota intestinale può utilizzare direttamente il triptofano, che viene metabolizzato in indolo, triptamina, derivati dell’acido indolico, scatolo e indicans (Gao et al., 2018). L’oleamide (cis-9,10-ottadecenoamide) è un’ammide primaria derivata dagli acidi grassi. Da oleoyl-CoA e glicina, la N-oleoilglicina si ottiene attraverso un enzima non ancora identificato che viene modificato in oleamide mediante l’enzima PAM (Chaturvedi et al., 2006). È stato identificato nel fluido ruminale da Artegoitia et al. (2017) come potenziale biomarcatore per i bovini efficienza alimentare. Il 20-carbossi-leucotriene B4 è un acido grasso a catena lunga identificato anche nel liquido ruminale da Artegoitia et al. (2017) come un potenziale biomarcatore per l’efficienza alimentare del bestiame e un metabolita omega-ossidato del leucotriene B4 (LTB4).
In definitiva, i risultati ottenuti dimostrano che somministrare una dieta con integrazione di foraggio verde a bufale in lattazione, influenza positivamente il profilo chimico del latte e del liquido ruminale. Ciò determina una modulazione dei diversi metaboliti benefici per la salute dell’uomo.
In futuro saranno necessari ulteriori studi per caratterizzare alcune molecole sconosciute non identificate con la metabolomica basata sull’analisi LC-MS e che possono essere considerate come biomarcatori per l’utilizzo di foraggi verdi in allevamento.
Il presente lavoro è una sinossi dell’articolo: Neglia G, Cotticelli A, Vassetti A, Matera R, Staropoli A, Vinale F, Salzano A, Campanile G. “Buffalo milk and rumen fluid metabolome are significantly affected by green feed.” Sci Rep. 2023 Jan 25;13(1):1381. doi: 10.1038/s41598-022-25491-w.
Bibliografia
Artegoitia, V. M. et al. Rumen fluid metabolomics analysis associated with feed efficiency on crossbred steers. Sci. Rep. 7, 2864. https:// doi. org/ 10. 1038/ s41598- 017- 02856-0 (2017).
Chaturvedi, S. et al. In vivo evidence that N-oleoylglycine acts independently of its conversion to oleamide. Prostaglandins Other Lipid Mediat. 81, 136–149. https:// doi. org/ 10. 1016/j. prost aglan dins. 2006. 09. 001 (2006).
de Almeida, R. T. R. et al. Exploring the rumen fluid metabolome using liquid chromatography-high-resolution mass spectrometry and molecular networking. Sci. Rep. 8, 17971. https:// doi. org/ 10. 1038/ s41598- 018- 36196-4 (2018).
Gao, J. et al. Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism. Front. Cell. Infect. Microbiol 6, 8–13. https:// doi. org/ 10. 3389/ fcimb. 2018. 00013 (2018).
Marklová, E. Where does indolylacrylic acid come from. Amino Acids 17, 401–413. https:// doi. org/ 10. 1007/ BF013 61665 (1999).
Rocchetti, G., Gallo, A., Nocetti, M., Lucini, L. & Masoero, F. Milk metabolomics based on ultra-high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry to discriminate different cows feeding regimens.Food Res. Int. 134, 109279. https://doi.org/10.1016/j.foodres.2020.109279 (2020)
Wagner, J. J. et al. Carcass composition in mature Hereford cows: Estimation and effect on daily metabolizable energy requirement during winter. J. Anim. Sci. 66, 603–612. https:// doi. org/ 10. 2527/ jas19 88. 66360 3x (1988)












































































