Studio sull’efficacia antielmintica, in vitro, di un estratto acquoso di melograno (Punica granatum L.) contro i nematodi gastrointestinali degli ovini.
Le infezioni parassitarie, in particolar modo quelle sostenute dai nematodi gastrointestinali, sono particolarmente diffuse negli ovini al pascolo e sono causa di malattia, con sintomatologia spesso poco evidente, che coinvolge gradualmente tutti i capi dell’allevamento inducendo una riduzione dell’efficienza alimentare, con conseguente diminuzione dell’incremento ponderale, delle produzioni quali-quantitative di latte, nonché un’alterazione delle performance riproduttive ed un accorciamento della carriera produttiva. In relazione al parassita e all’intensità parassitaria, possono provocare numerosi danni all’ospite, determinando malattie cliniche e subcliniche, caratterizzate da depressione del sensorio, diarrea, inappetenza, anemia, turbe metaboliche, stress, ecc. Tutto ciò va ad incidere inesorabilmente anche sul benessere animale.
Per tali ragioni, nel corso degli anni, le aziende farmaceutiche hanno sviluppato numerosi farmaci antielmintici. Attualmente, i programmi di controllo dei nematodi gastrointestinali degli ovini, in assenza di vaccini efficaci, sono basati prevalentemente sull’uso di questi farmaci di sintesi, con trattamenti spesso effettuati senza alcuna diagnosi parassitologica. Dopo anni di intenso utilizzo di antielmintici sintetici per ottimizzare la produttività animale, è stata inevitabile la comparsa di elminti resistenti a una o più classi di farmaci e l’uso intensivo, come anche il sotto-dosaggio e i trattamenti ripetuti con gli stessi farmaci, hanno fatto sì che questo fenomeno diventasse un grave e crescente problema negli allevamenti ovini in molti paesi a livello globale. Numerose pubblicazioni scientifiche indicano, a vari livelli, un aumento della resistenza antielmintica anche in Europa, Italia compresa, evidenziando come questo fenomeno rappresenti una gravissima minaccia per l’intero settore zootecnico.
Nonostante il farmaco rappresenti ancora oggi lo strumento principale per contrastare le infezioni sostenute dai nematodi gastrointestinali negli ovini, al fine di ridurre l’insorgenza di antelmintico-resistenza è indispensabile non solo utilizzare questo strumento in modo corretto e razionale, ma anche monitorare costantemente gli allevamenti al fine di individuare precocemente i fenomeni di antielmintico-resistenza e indentificare e convalidare metodi alternativi per un controllo più sostenibile di queste parassitosi.
In molti paesi del mondo, le piante, o parti di esse (frutti, semi, cortecce, radici, ecc.), sono state utilizzate nelle tradizioni locali per il controllo dei parassiti degli ovini. Queste tradizioni sono sopravvissute in molte zone d’Italia, come in alcune regioni meridionali, dove diverse miscele vegetali, tra cui quelle a base di melograno (Punica granatum), vengono utilizzate per il controllo delle infezioni parassitarie negli animali da reddito. Pertanto, l’obiettivo dello studio è stato quello di valutare, in vitro, l’efficacia antielmintica di un macerato acquoso di melagrana utilizzato nella regione Calabria per il controllo dei nematodi gastrointestinali degli ovini. Il macerato utilizzato in questo studio è una miscela tradizionale a base dell’intero frutto del melograno, preparata da un anziano allevatore calabrese secondo antiche ricette etno-veterinarie tramandate da secoli di generazione in generazione.
Al fine di individuare le principali molecole responsabili dell’attività antielmintica, il macerato è stato frazionato, secondo la solubilità in metanolo, ottenendo in tal modo una frazione metanolica (A) e un residuo insolubile (B). Nella frazione A, l’acido gallico, quantitativamente predominante (13% dell’estratto metanolico), è stato purificato per ottenere la molecola pura (C).
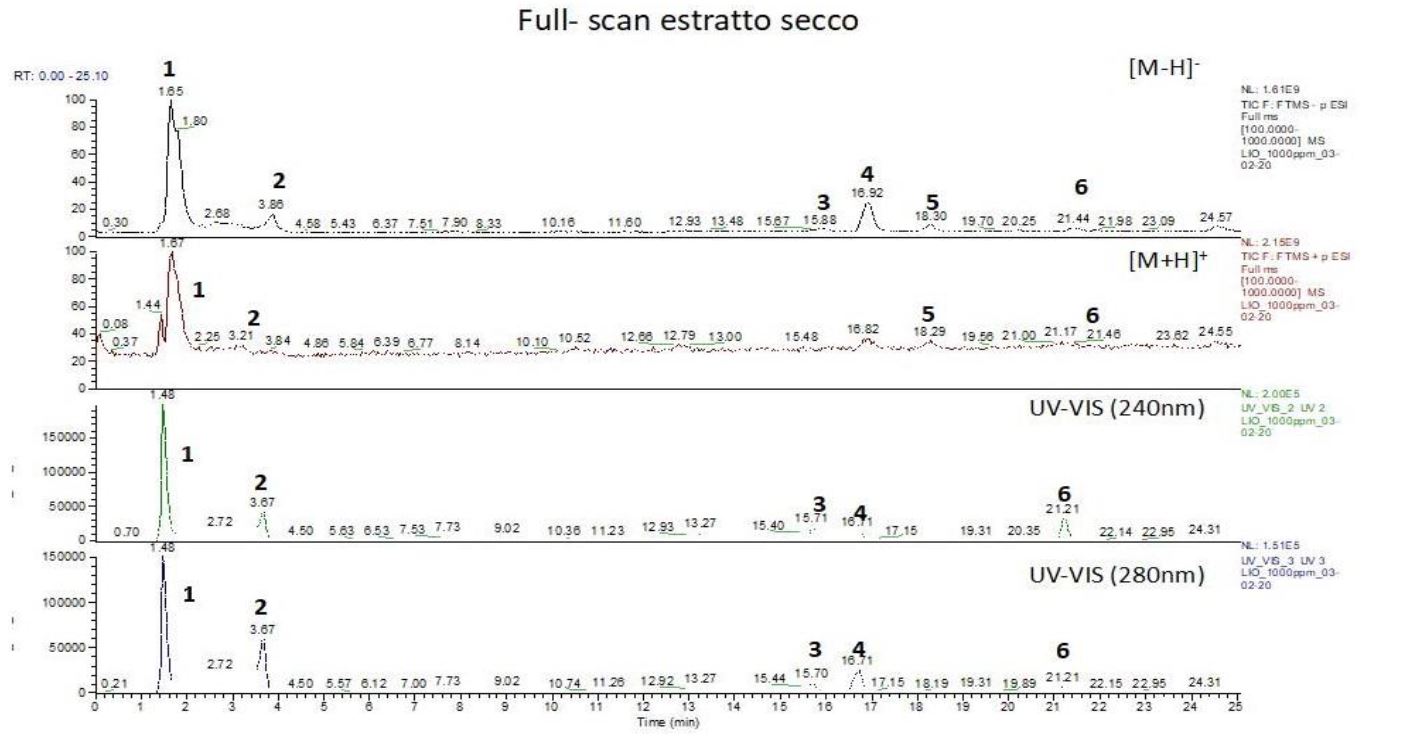
Le tre frazioni ottenute (A, B e C) sono state sottoposte ad analisi LC/HRMS per l’identificazione dei loro componenti e confrontate con il macerato acquoso. La figura di seguito riporta i cromatogrammi relativi alla Full scan analysis dell’estratto secco, analizzato contemporaneamente in modalità ESI(+), ESI(-) UV/VIS (240 nm) e UV/VIS (280 nm).
Dall’esame del cromatogramma è possibile individuare, in funzione dei tempi di ritenzione dei componenti della miscela, due regioni distinte: una prima, compresa tra 0-5 min r.t.,, nella quale ricadono le molecole non fortemente trattenute dalla fase stazionaria, in particolare zuccheri semplici e complessi (composti 1 e 2), e una seconda regione, compresa tra 15-25 min r.t., dove ricadono i picchi caratteristici di acidi fenolici ed elagiotannini (composti 3, 4, 5 e 6).
Per ciascuno dei picchi rappresentativi, al fine di giungere ad una loro completa identificazione, è stata eseguita l’analisi MS/MS Esi. Il picco identificato con il numero 1 è costituito da una miscela di Acido tartarico, Acido glucuronico, Mannitolo ed una piccola percentuale di un Elagitannino complesso (2,3-(S)-esaidrossidifenoil-D-glucosio). Il picco identificato col numero 2 è rappresentato dall’Acido gallico e infine i rimanenti componenti, indicati coi numeri da 3 a 6, sono rappresentati da 2 derivati elagiotanninici, Acido valoneico e Felligridina J (3), Acido siringico (4), Acido ellagico, Ducheside A (6) e da una molecola incognita corrispondente al picco 5.
Le tre frazioni ottenute sono state utilizzate per test in vitro per verificare l’efficacia antielmintica. A tale scopo sono stati prelevati campioni coprologici da ovini naturalmente infettati da nematodi gastrointestinali e per valutare l’efficacia è stato eseguito il test di schiusa delle uova (Egg Hatch Test – EHT), seguendo le linee guida raccomandate dalla World Association for the Advancement of Veterinary Parasitology – WAAVP (Coles et al., Vet Parasitol., 1992). Il test di laboratorio utilizzato si basa sulla capacità degli estratti di inibire la schiusa delle uova di nematodi gastrointestinali in larve di primo stadio.
In particolare, ciascuna frazione è stata testata in triplicato alle concentrazioni di 1mg/mL, 0,5 mg/mL, 0,25 mg/mL, 0,125 mg/mL, 0,05 mg/mL e 0,005 mg/mL, utilizzando per il controllo positivo il Tiabendazolo (TBZ) alle concentrazioni finali di 0,2 and 0,5 mg/mL e per il controllo negativo acqua deionizzata con DMSO allo 0,5%.
I risultati dell’EHT hanno evidenziato, in tutte le frazioni, una significativa inibizione della schiusa delle uova entro 48 h dall’esposizione (p <0,05), evidenziando un’elevata efficacia in vitro (> 82%) a tutte le concentrazioni testate. In particolare, il massimo effetto è stato riscontrato nella frazione A (99,3 % alla concentrazione massima di 1 mg/mL e 89,3 % alla concentrazione minima di 0,005 mg/mL), seguito dalla frazione B (94,7% alla concentrazione massima di 1 mg/mL e 85,3% alla concentrazione minima di 0,005 mg/mL) e dalla frazione C (94,0% e 82,7% rispettivamente alla concentrazione massima di 1 mg/mL e a quella minima di 0,005 mg/mL).
L’effetto riscontrato è verosimilmente attribuibile all’azione sinergica dei componenti evidenziati attraverso la caratterizzazione chimica del fitocomplesso. In particolare, nella frazione A, l’inibizione della schiusa delle uova è certamente riconducibile all’azione dei diversi derivati tannici e Acidi fenolici. Per quanto riguarda la Frazione B, è ipotizzabile un contributo significativo dell’Acido tartarico e dell’Ellagitannino, mentre è abbastanza sorprendente l’attività della frazione C, riconducibile esclusivamente all’Acido gallico.
Questo studio ha convalidato, in vitro, il potenziale antielmintico di questa miscela tradizionale a base di melagrana, evidenziando il ruolo dell’acido gallico come componente principale e giustificando la necessità di eseguire ulteriori studi in vivo su questi rimedi etno-veterinari utilizzati per il controllo dei nematodi gastrointestinali degli ovini, al fine di confermare i risultati ottenuti e valutare il potenziale terapeutico e la futura applicabilità.
Tratto da “In Vitro Anthelminthic Efficacy of Aqueous Pomegranate (Punica granatum L.) Extracts against Gastrointestinal Nematodes of Sheep“, Pathogens 2020, 9(12), 1063; doi.org/10.3390/pathogens9121063.
Autori
Fabio Castagna1, Domenico Britti1, Manuela Oliverio1, Antonio Bosco2, Sonia Bonacci1, Giuseppe Iriti1, Monica Ragusa3, Vincenzo Musolino1, Laura Rinaldi2, Ernesto Palma1 and Vincenzo Musella1
1 Dipartimento di Scienze della Salute, Università degli Studi “Magna Græcia” di Catanzaro, CISVetSUA
2 Dipartimento di Medicina Veterinaria e Produzioni Animali- Università degli Studi “Federico II” di Napoli, CReMoPar
3 Dipartimento di Medicina Sperimentale e Clinica, Università degli Studi “Magna Græcia” di Catanzaro